在過去幾十年,全球經(jīng)歷了多次嚴(yán)重的病毒大流行,如2009年的豬流感病毒、2013-2016年的埃博拉病毒、2015-2016年的寨卡病毒以及2019年末開始的COVID-19病毒等。這些疫情導(dǎo)致了大量人員失去生命,造成重大的經(jīng)濟(jì)和社會(huì)損失。目前,可用的大多數(shù)病毒檢測(cè)方法大多靶向特定的病毒核酸和蛋白質(zhì)生物標(biāo)志物。然而,這些方法要么需要復(fù)雜的PCR操作,要么就是靈敏度和可靠性較差。
近期,美國(guó)加州大學(xué)(University of California)的Holger Schmidt教授,楊百翰大學(xué)(Brigham Young University)的Aaron R. Hawkins教授和得克薩斯生物醫(yī)學(xué)研究所(Texas Biomedical Research Institute)的Jean L. Patterson教授在期刊Proceedings of the National Academy of Sciences of the United States of America上聯(lián)合發(fā)表了一篇題為“Label-free and amplification-free viral RNA quantification from primate biofluids using a trapping-assisted optofluidic nanopore platform”的工作,報(bào)告了一種集成的光流控納米孔平臺(tái),用于對(duì)各種生物樣品液體中病毒的RNA載量進(jìn)行無標(biāo)記和無擴(kuò)增的定量測(cè)定。

先前,該團(tuán)隊(duì)報(bào)道過一種用于納米孔檢測(cè)的光流控方法,即借助捕獲區(qū)域輔助提高捕獲率的技術(shù)(trapping-assisted capture rate enhancement,TACRE),并將其應(yīng)用于合成低聚物和鼻拭子樣本中的SARS-CoV-2 RNA。該方法是基于將核酸靶標(biāo)固相提取到微珠上用于確保檢測(cè)的特異性,然后這些微珠被光捕獲至納米孔的電捕獲半徑內(nèi),在那里靶標(biāo)可被熱釋放并快速連續(xù)地通過納米孔易位。在本工作中,該團(tuán)隊(duì)報(bào)告了這一技術(shù)概念作為臨床診斷工具的驗(yàn)證,對(duì)靈長(zhǎng)類動(dòng)物模型中的病毒——寨卡病毒和SARS-CoV-2進(jìn)行研究。
首先,研究人員構(gòu)建了如圖1所示的納米孔集成光流控平臺(tái)和實(shí)驗(yàn)裝置。20 nm直徑的納米孔隙位于凸起上方的氧化膜中(T4時(shí)間點(diǎn)附近),Ag/AgCl電極在納米孔②和出口③之間產(chǎn)生電勢(shì)差,膜片鉗電流放大器與電極連接,以測(cè)量納米孔上的離子電流信號(hào)。與先前的TACRE工藝不同的是,本工作設(shè)計(jì)將磁珠推入凸起中,阻止磁珠暴露在流體流動(dòng)中,減小磁珠上所釋放的靶標(biāo)被沖走的可能性,從而進(jìn)一步降低檢測(cè)的LOD。如圖所示,理論上將攜帶靶標(biāo)的微珠遞送至納米孔的過程可分為四個(gè)不同的時(shí)間點(diǎn)(T1-T4),在此期間,微珠將受到各種力的組合作用,如Ff(流體流動(dòng)力),F(xiàn)g(梯度力)和Fs(散射力,作用于光傳播的方向)。可以看到,當(dāng)散射力超過流體流動(dòng)力時(shí),珠子將被推入凸起。在凸起內(nèi)部,僅Fs發(fā)揮作用,這促進(jìn)了磁珠被有效地光捕獲在納米孔附近。隨后,通過熱釋效應(yīng),靶分子便能迅速被納米孔檢測(cè)。
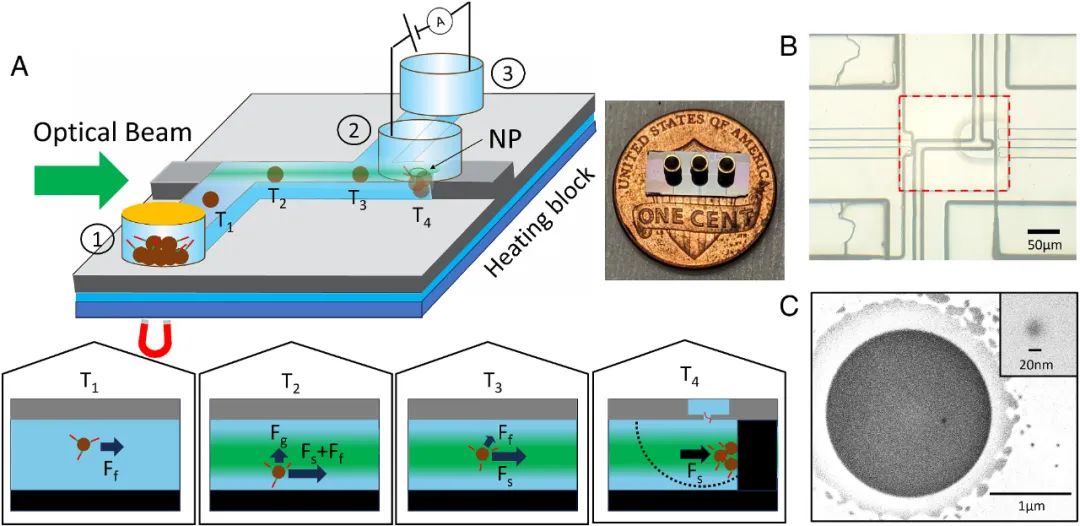
圖1 納米孔集成光流體平臺(tái)及其工作原理示意圖。
隨后,該團(tuán)隊(duì)構(gòu)建了基于磁珠的固相提取方法來從復(fù)雜的生物流體中(全血、尿液、精液)提取特定的病毒RNA。該固相萃取過程首先是通過基于鏈霉親和素-生物素的附著過程,將磁珠表面修飾上具有標(biāo)靶特異性的下拉序列。然后,將已知數(shù)量的功能化微珠與RNA樣品混合,直到珠子上收集了所有靶標(biāo)。后續(xù),這些磁珠的一部分將會(huì)被光學(xué)捕獲在納米孔附近,其表面的靶RNA會(huì)被熱釋放進(jìn)而檢測(cè)。為了定量病毒RNA的濃度,該團(tuán)隊(duì)根據(jù)每個(gè)微珠上附著的病毒RNA估計(jì)數(shù)量、生物流體中RNA數(shù)量、與RNA樣品混合的珠子總數(shù)等,估算出根據(jù)TACRE方法得到的病毒RNA濃度的計(jì)算公式。
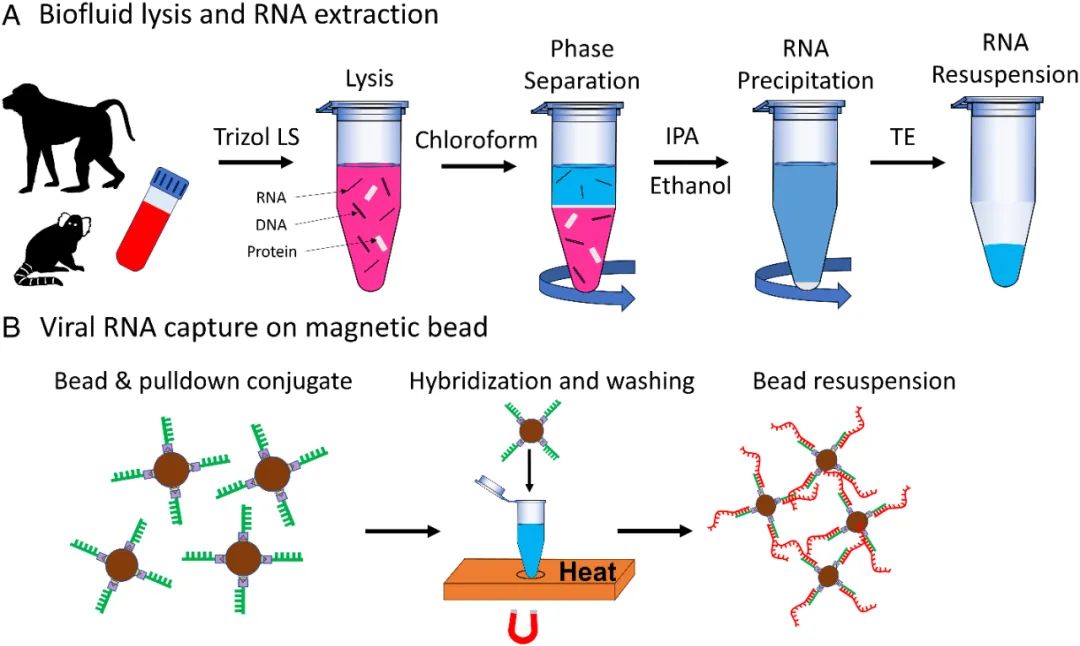
圖2 生物流體裂解和RNA提取流程示意圖。
圖3A展示了當(dāng)空磁珠(無靶標(biāo))被光學(xué)捕獲并在加熱后的納米孔電流信號(hào),結(jié)果顯示無假陽性信號(hào)。接著,該團(tuán)隊(duì)以狨猴精液樣本為例進(jìn)行了TACRE測(cè)定,并以PCR的結(jié)果作為獨(dú)立參考。在光學(xué)捕獲階段,4個(gè)攜帶靶標(biāo)的磁珠被捕獲在納米孔附近,熱釋放后,納米孔采集到的特征易位信號(hào)如圖3B所示,最終共有2620個(gè)易位信號(hào)被觀察到。計(jì)算得到的病毒濃度,與qPCR的參考值相近。

圖3 利用寨卡病毒感染狨猴的精液樣本進(jìn)行的捕獲率提高實(shí)驗(yàn)結(jié)果。樣本是在接種后第 9 天采集的。
最后,該團(tuán)隊(duì)將該檢測(cè)方案應(yīng)用于寨卡病毒和SARS-CoV-2的綜合縱向研究,以跟蹤四周內(nèi)多個(gè)生物體液樣本感染過程中的病毒載量。通過比較三種樣品的納米孔測(cè)量結(jié)果和qPCR結(jié)果發(fā)現(xiàn),納米孔測(cè)得的值與qPCR參考值具有良好的一致性,且納米孔傳感器所獲得的病毒濃度值始終高于qPCR的結(jié)果。而這可能是因?yàn)闊o需逆轉(zhuǎn)錄、擴(kuò)增等可能丟失靶標(biāo)的操作。
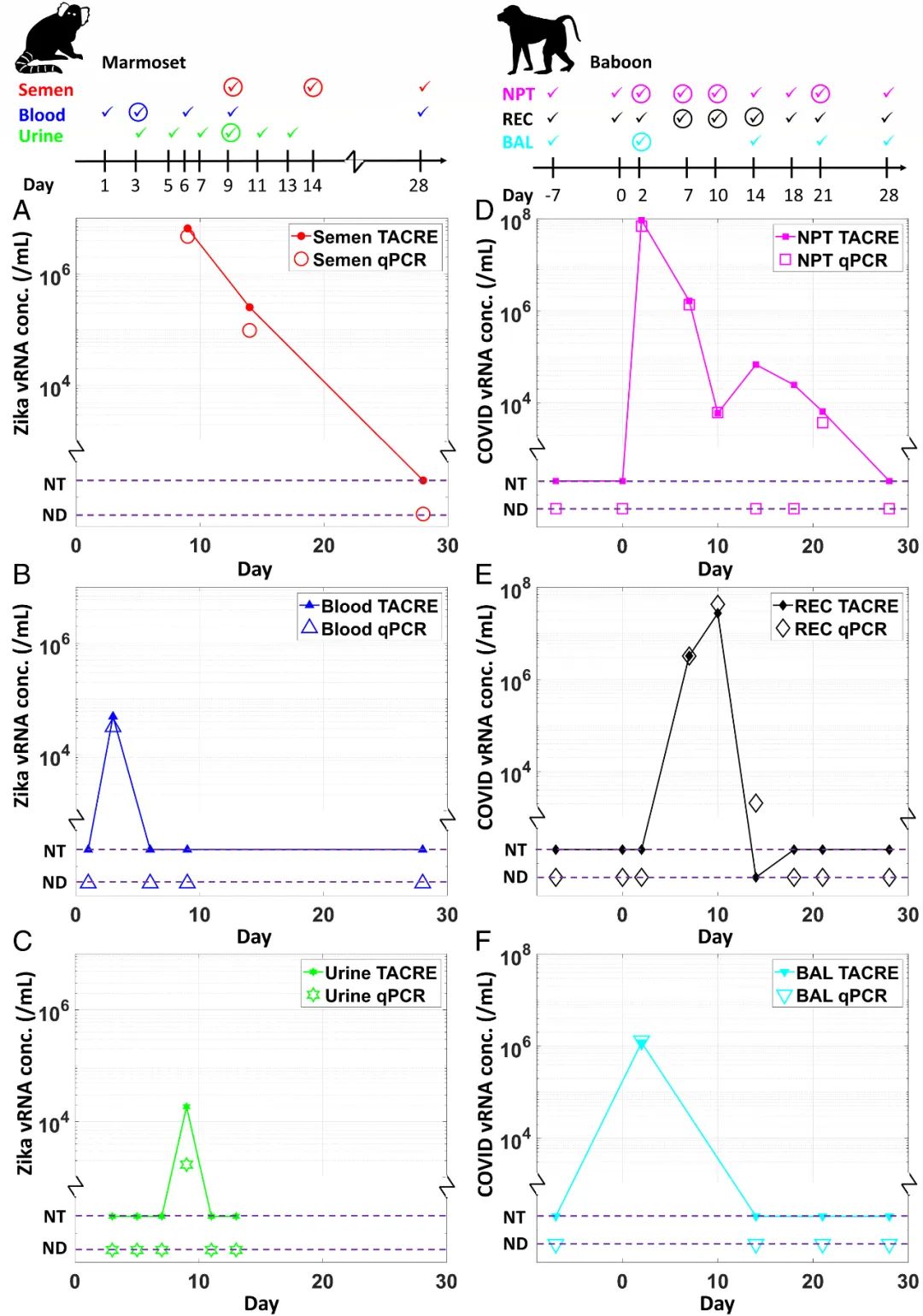
圖4 利用光流控納米孔平臺(tái)進(jìn)行的臨床生物流體縱向TACRE研究。
綜上所述,研究人員展示了一種集成的光流控納米孔平臺(tái),用于臨床生物流體樣本中病毒RNA的無標(biāo)記和無擴(kuò)增定量檢測(cè)。采用優(yōu)化后的固相提取方法,研究人員將病毒的RNA固定于微珠表面,從而簡(jiǎn)化并增強(qiáng)了目標(biāo)分離的選擇性。利用光學(xué)捕獲系統(tǒng),微珠被精準(zhǔn)遞送到納米孔傳感器旁,并通過熱激活手段迅速釋放目標(biāo)顆粒。這一過程將局部目標(biāo)顆粒的濃度大幅提升至100萬倍以上,極大地加速了診斷速度,并且支持高通量檢測(cè)。
論文鏈接:
https://doi.org/10.1073/pnas.2400203121
-
電流放大器
+關(guān)注
關(guān)注
4文章
42瀏覽量
24551 -
PCR
+關(guān)注
關(guān)注
0文章
120瀏覽量
19659
原文標(biāo)題:用于納米孔檢測(cè)的光流控平臺(tái),實(shí)現(xiàn)動(dòng)物體液中病毒RNA的無標(biāo)記定量檢測(cè)
文章出處:【微信號(hào):Micro-Fluidics,微信公眾號(hào):微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請(qǐng)注明出處。
發(fā)布評(píng)論請(qǐng)先 登錄
相關(guān)推薦
微流控技術(shù)在病原微生物檢測(cè)中的研究進(jìn)展
HDI盲孔工藝中孔內(nèi)無銅的檢測(cè)技術(shù)
基于磁珠操控的微流控平臺(tái)實(shí)現(xiàn)副溶血性弧菌的快速捕獲與檢測(cè)
頻閃儀的正確使用方法
在目標(biāo)檢測(cè)中大物體的重要性

博揚(yáng)智能對(duì)射傳感器精度檢測(cè),精度受到多個(gè)因素的影響

三星2億像素3層堆棧式傳感器即將問世,思特威推出工業(yè)面陣5MP全局快門近紅外增強(qiáng)CMOS圖像傳感器

OndoSense推出用于防撞和定位的新型雷達(dá)傳感器 可以檢測(cè)到0.1米的物體
利用無標(biāo)記光流控平臺(tái),實(shí)現(xiàn)對(duì)生物納米顆粒的分子指紋識(shí)別

無損檢測(cè)技術(shù)中工業(yè)CT檢測(cè)與X-RAY射線檢測(cè)

用于單分子無標(biāo)記定量檢測(cè)的數(shù)字膠體增強(qiáng)拉曼光譜技術(shù)

工業(yè)X光機(jī)無損檢測(cè)設(shè)備的主要用途

集成3D微電極的微流控芯片,用于土壤養(yǎng)分離子的現(xiàn)場(chǎng)快速定量檢測(cè)

X光機(jī)工業(yè)CT無損檢測(cè)設(shè)備在不同行業(yè)的應(yīng)用

電感耦合等離子體質(zhì)譜+DNA納米機(jī)器人用于HPV病毒的高效檢測(cè)




 用于納米孔檢測(cè)的光流控平臺(tái),實(shí)現(xiàn)動(dòng)物體液中病毒RNA的無標(biāo)記定量檢測(cè)
用于納米孔檢測(cè)的光流控平臺(tái),實(shí)現(xiàn)動(dòng)物體液中病毒RNA的無標(biāo)記定量檢測(cè)










評(píng)論