增強子是基因組中一類非編碼調控元件,它能使細胞內特定的基因得到明顯地上調。在基因調控的過程中,增強子在序列特異性轉錄因子的引導下,與相應的啟動子發(fā)生作用,以激活下游基因的表達。正常的增強子激活在維持哺乳動物細胞中基因的發(fā)展方面起著重要的作用。然而,基因不可控的表達增強會導致細胞產(chǎn)生一系列異常的行為,如腫瘤的發(fā)生和過度增殖。鑒定增強子的活性,特別是在活細胞中,將為解析癌癥中基因表達異常的機制提供重要線索。
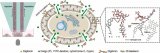
近日,北京航空航天大學常凌乾課題組在ACS Sensors期刊上發(fā)表了一篇名為“Sensitive Interrogation of Enhancer Activity in Living Cells on a Nanoelectroporation-Probing Platform”的文章。該研究工作中發(fā)展了一種納米電穿孔探針平臺,通過采用納米電穿孔生物芯片,利用納米孔提供聚集的電場,實現(xiàn)細胞膜的可逆穿孔,同時產(chǎn)生電泳力,將用于增強子活性檢測的探針高效地遞送至細胞核內(圖1)。
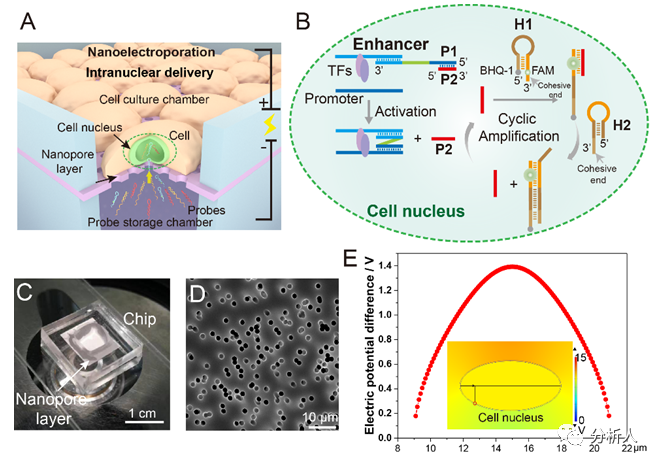
圖1 納米電穿孔探針平臺用于活細胞內增強子活性鑒定:(A)納米電穿孔探針平臺工作原理;(B)PH探針鑒定增強子活性并產(chǎn)生放大熒光信號的原理;(C)納米電穿孔生物芯片實物圖;(D)納米孔的電鏡掃描圖像;(E)細胞核靠近納米孔附近的膜內外電勢差模擬結果。
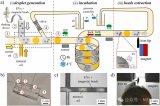
由于增強子激活基因表達的方式取決于其與啟動子的相互作用,鑒定增強子活性實際上意味著評估目標增強子與啟動子之間的相互作用。考慮到這種相互作用的獨特性,該團隊設計了一組DNA探針,名為“PH探針”。PH探針由序列P1、P2、H1和H2組成。其中,P1與P2互補結合。H1和H2可自組裝為具有粘性末端的“發(fā)卡”結構。P1的3’端能夠特異性結合增強子序列。當增強子與啟動子相互作用,P1的5’端將與啟動子序列結合,原本結合在P1上的P2被替換下來。替換下來的P2能夠與H1的粘性末端結合,并打開H1的發(fā)卡結構,使熒光基團遠離淬滅基團而恢復熒光。隨后,H2的粘性末端將與H1結合,使結合在H1上的P2被替換下來。被替換下來的P2又能與新的H1結合,繼而開始新一輪的熒光信號恢復,最終使熒光信號產(chǎn)生百倍增強(圖2)。
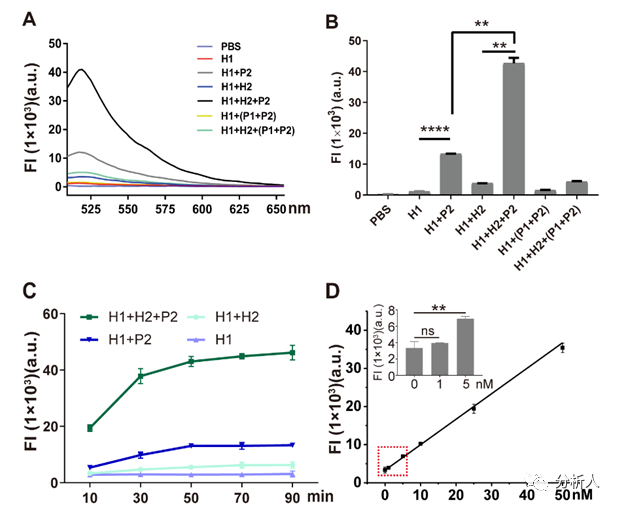
圖2 PH探針的功能驗證:(A)H1和H2探針對序列P2的識別能力;(B)PH探針在不同序列搭配下的熒光強度;(C)H1和H2探針檢測序列P2的反應時間;(D)H1和H2探針檢測序列P2的熒光強度的校準曲線,插圖顯示H1和H2檢測序列P2的檢測限為5 nM。
利用納米電穿孔生物芯片將PH探針高效且安全地遞送至活細胞內,該平臺成功地在活細胞內鑒定了CCAT1增強子活性。CCAT1是一種長鏈非編碼RNA,參與腫瘤侵襲和轉移,其在腫瘤中的異常高表達已被報道與增強子激活有關。該平臺將傳統(tǒng)增強子活性檢測方法的時間從幾天縮短到不到一個小時,同時,保證了細胞的高活性。這為活細胞內增強子的活性檢測以及細胞的行為關聯(lián)分析,提供了便捷的研究平臺(圖3)。
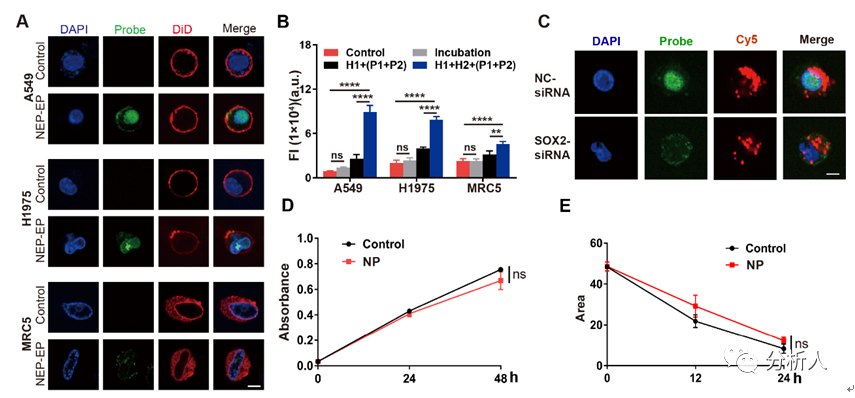
圖3 納米電穿孔探針平臺檢測活細胞內CCAT1增強子活性:(A)PH探針檢測細胞的熒光圖像;(B)細胞熒光強度統(tǒng)計數(shù)據(jù);(C)采用siRNA轉染A549細胞后,使用納米電穿孔探針平臺檢測得到的細胞熒光圖像;(D)利用CCK8試劑盒對細胞的增殖能力進行鑒定;(E)細胞遷移一段時間后的劃痕區(qū)域,以表征細胞的遷移行為。
為了驗證該平臺的性能,該團隊在22個臨床原代細胞樣本中鑒定了CCAT1增強子的活性,并發(fā)現(xiàn)在肺癌原代細胞中CCAT1增強子的活性較正常肺癌細胞明顯增加,且不同細胞樣本間存在異質性(圖4)。
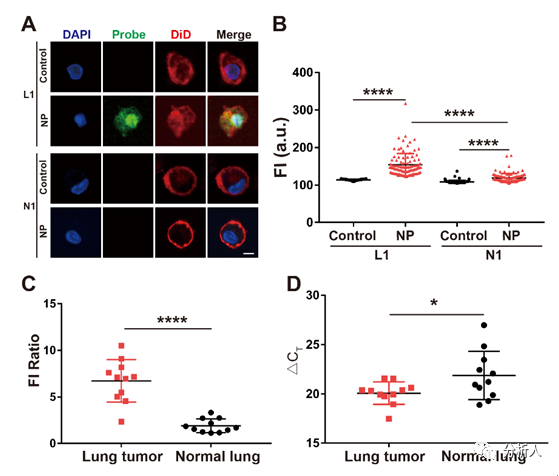
圖4 臨床細胞樣本中增強子活性的鑒定:(A)檢測原代細胞樣本L1和N1的熒光圖像;(B)計數(shù)100個細胞的熒光強度統(tǒng)計結果;(C)原代肺腫瘤細胞樣本與原代正常肺細胞樣本的熒光強度比值比較;(D)CCAT1在原代肺腫瘤細胞(L1-L11)和原代正常肺細胞(N1-N11)中的表達比較。
該研究工作第一作者是萬鳳奇博士,共同第一作者董再再博士。通訊作者北航常凌乾教授、董再再博士。文章第一單位為北京航空航天大學生物與醫(yī)學工程學院,合作單位為蘭州大學第二醫(yī)院與北京大學腫瘤醫(yī)院。
論文鏈接:
https://pubs.acs.org/doi/pdf/10.1021/acssensors.2c01187
審核編輯 :李倩
-
納米
+關注
關注
2文章
699瀏覽量
37145 -
探針
+關注
關注
4文章
211瀏覽量
20533
發(fā)布評論請先 登錄
相關推薦
OptiFDTD應用:用于光纖入波導耦合的硅納米錐仿真
應用于活細胞成像的一次性細胞培養(yǎng)芯片
微波測量探針

探針式溫度計使用的正確流程是
開爾文探針測試原理是什么
分享:晶圓探針測試中探針臺的自動化控制
連接器與穿孔機如何連接
基于納米壓印超構透鏡陣列的增強現(xiàn)實方案

蔡司利用納米探針技術探索半導體微觀電學性能

基于微流控的納米細胞芯片,用于肺癌免疫治療的精準預測





 納米電穿孔探針平臺,用于活細胞增強子活性鑒定
納米電穿孔探針平臺,用于活細胞增強子活性鑒定











評論