摘要:在實際的工藝生產中,大眾對于碳酸鋰產品的提純濃度要求也非常高。而由于鹽湖鹵水以及自身生產技術等條件的限制,直接進行碳酸鋰的提純是具有一定難度的,必須從實際出發,使用鹵水制備的粗級碳酸鋰作為提純原料,通過氫化分解后進行工業提純,本文研究了氫化反應中的一些對碳酸鋰溶解產生的影響因素。
近年來,伴隨著我國科學技術的不斷發展,使得無論是企業還是研究部門,都是對于碳酸鋰的提純濃度提出越來越高的要求,這樣也給提純精度帶來挑戰。然而就現實情況來說,大部分的初級碳酸鋰產品并不能很好的滿足市場需求。因此可以發現,我們針對新型的碳酸鋰提純方法進行理論性的研究分析。無論是對于工程應用,還是對于理論研究,都存在有非常積極地現實意義。研究表明,雖然氫化沉淀法在實驗中能夠很好的提純碳酸鋰,但是不可忽視的是,該實驗過程對于氫氧化鋰的純度要求非常的高,這樣就無形之中加重了實驗成本。在本文的研究中,我們華林科納主要分析采用氫化分解來提純碳酸鋰,希望可以為今后相關領域的理論研究提供參考。
1實驗操作部分
1.1實驗原料以及實驗儀器
實驗原料:利用鹽湖鹵水自制的粗級碳酸鋰產品。實驗儀器:玻璃轉子流量計、智能超級恒溫水槽、電動攪拌器、原子吸收分光光度計、循環水式多用真空泵。
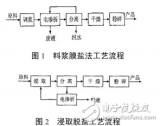
1.2碳酸鋰工藝的實驗過程
就現實情況來說,粗級鋰的產品中存在有大量的雜質成分,其中鎂離子可以說是占據有很大的比重。因為鎂離子和鋰離子的化學特性非常的相似,因此,如果只是單純的采用氫化分解來提純粗級鋰,那么往往并不能很好的獲得理想結果。因此,在本章節的研究中,我們逐步對于碳酸鋰工藝的實驗過程進行分析。
(1)實驗操作的氫化階段。在實驗的初始階段,我們應該設定好實驗溫度,可以稱取10g粗級鋰產品放置于500ml的容器中,接著人為的把氫化溫度控制在10℃、15℃、20℃、25℃、30℃、40℃進行氫化。經過150分鐘之后,我們在對于溶液實施抽濾,這樣就能夠很好的測量液體中鋰鎂的離子含量;除此之外,我們還應當對于影響溶解鎂雜質的溫度因素進行分析。結合實驗我們可以發現,無論是化學反應中的氣液傳質還是反應速率,都在很大程度上受到溫度的影響。研究表明,伴隨著溫度的不斷升高,化學反應速率也在不斷加快。然而就現實情況來說,伴隨著實驗溫度的不斷升高,實驗中的反應物以及反應物的溫度便會逐步減小,這樣的話,就在某種程度上減小了傳質的推動能力,與此同時,化學反應的實驗速率逐步減慢。
(2)實驗操作的除鎂階段。我們在實際的實驗過程中,為了能夠最大程度上除去溶液中的鎂離子,于是采用了氫氧化鈉溶液。研究表明,氫氧化鈉除了可以除去鎂雜質,同時還可以很好的確保損失鋰的程度達到最小,這大部分是因為鎂離子相對于其他元素的質量分數比較小,這樣就使得我們在實驗操作過程中并不需要投入大量的氫氧化鈉溶液。因此可以發現,我們所加入的氫氧化鈉溶液的計量應該是純凈的,換句話說,溶液中的氫氧化鈉應該是百分之百的。
(3)實驗操作的蒸發階段。當我們采用氫氧化鈉對于溶液進行除鎂操作之后,那么要想能干進一步獲得高純度的碳酸鋰,只需要進行高溫進行分解即可。結合熱力學的參數計算可知,碳酸氫鋰的理論熱分解溫度為4.25℃。然而需要注意的是,低溫環境并不利于粗級碳酸鋰的快速分解。因此,如果想要適當的加速化學分解,那么可以采用加熱溫度的方法。然而研究發現,實驗溫度并不是越高越好,如果穩定過高的話,那么很有可能使得溶液黏在壁上,給后期化學反應結果造成某種程度上的影響。因此可以發現,我們在實驗操作的過程中,一般情況是將反應的溫度保持在90攝氏度左右。然而在分解結晶的時候,經常會伴隨著可見氣體排出。這樣的話,整個化學反應也會在某種程度上受到攪拌速率的影響。通過大量的實驗操作可以發現,碳酸鋰的顆粒越小,那么越容易獲得理想的實驗結果。因此,我們在實驗過程中一般是通過加速攪拌,進而獲得理想的微小的碳酸鋰顆粒。
2結語
綜上所述,與其他的提純方法相比,本文提出的采用氫氧化鈉溶液來提純粗級碳酸鋰的方法存在有非常理想的特性。比如說采用氫氧化鈉溶液提純的實驗過程非常的簡單容易操作;與此同時,所提純的碳酸鋰純度也非常的高。除此之外,提純后的鹵水本身也存在有非常好的工業價值。在當前工業領域中,鹵水可以進一步作為其他產品的提純,這樣的話,就可以很好的實現剩余液體的再次利用。在本次的研究分析中,雖然我們已經采用氫氧化鈉溶液去除了溶液中的鎂離子,但是溶液中仍然存在有一些雜質是無法采用氫氧化鈉去除的。因此,我們華林科納要想能夠在實驗室真正意義上去除更多的雜質,可以引入一些其他的試驗方法。
-
碳酸鋰
+關注
關注
1文章
155瀏覽量
10342 -
生產工藝
+關注
關注
1文章
31瀏覽量
9966
發布評論請先 登錄
相關推薦
價格腰斬之后的碳酸鋰如何發展
國內碳酸鋰市場開始觸底回升
供需錯配是碳酸鋰價格上漲主因
碳酸鋰價格拐點已經到來?
碳酸鋰真實的供給需求如何?碳酸鋰價格支撐點在哪?
僅僅一周,碳酸鋰再次下跌!
碳酸鋰期貨噸價跌破10萬元 未來鋰價預期如何?




 碳酸鋰生產工藝的實驗過程
碳酸鋰生產工藝的實驗過程












評論